Reprodução Assistida é o termo utilizado para o conjunto de técnicas
para tratamento da infertilidade conjugal que envolvem a manipulação em
laboratório de pelo menos um dos gametas: espermatozoides ou óvulos. As técnicas
amplamente utilizadas são a inseminação intra-uterina (IIU), a fertilização in
vitro (FIV) e a injeção intracitoplasmática de espermatozóides (ICSI). Estes
procedimentos podem ser realizados com os gametas do casal ou, em casos de
esterilidade ou de transmissão de doenças dominantes, pode-se
utilizar espermatozoides de banco de sêmen ou óvulos doados. Ainda não há
disponível banco de óvulos. A legislação em relação às técnicas de reprodução
assistida e à doação de gametas é diferente em diferentes
países.
Os casais que se submetem a técnicas de reprodução assistida devem ser
esclarecidos exaustivamente sobre os procedimentos a que serão submetidos. É
conveniente que leiam e assinem consentimentos informados sobre os
procedimentos.
Inseminação intra-uterina ou Inseminação
Artificial
È a técnica mais simples de reprodução assistida, dita de baixa
complexidade. Nela se manipula em laboratório apenas os espermatozóides (gameta
masculino). A inseminação intra-uterina é a colocação dos espermatozóides
preparados dentro do útero, sendo que a fertilização (penetração do
espermatozóide no óvulo) ocorre no ambiente natural – a trompas. A inseminação
intra-uterina está indicada em casos de fator masculino leve e em infertilidade
sem causa aparente (principalmente quando a mulher é jovem). Neste procedimento
deve-se ter certeza de que as trompas estão normais, pois elas deverão captar o
óvulo, fornecer condições para que ocorra a fertilização (penetração do
espermatozóide no óvulo) e transportar o embrião até o útero.
Para inseminação intra-uterina, o parceiro coleta o sêmen por masturbação,
e a seguir o sêmen é capacitado (preparado). Preparar ou capacitar o sêmen
significa separar os espermatozóides móveis e normais do líquido seminal. Esta
capacitação permite muitas vezes que os espermatozóides melhorem seu padrão de
movimento, tornando-se mais rápidos e direcionados. Isto é realizado por
técnicas de centrifugação e lavagem do sêmen. A figura abaixo ilustra uma das
técnicas de capacitação dos espermatozóides.
FIGURA: Uma das técnicas de capacitação espermática. No último tubo estão
os espermatozóides capacitados.
Para que a inseminação intra-uterina tenha resultados satisfatórios é
necessário que, após o preparo do sêmen, a concentração de espermatozóides
móveis e direcionados seja de aproximadamente 10 milhões de espermatozóides
móveis e direcionados por ml. Por isto, em casais cujo espermograma está muito
alterado este procedimento não é realizado. Freqüentemente se associa a
inseminação intra-uterina à indução da ovulação na mulher. Nestes casos deve se
ter o cuidado de controlar o número de óvulos que estão crescendo (com ecografia
transvaginal seriada) e que terão possibilidade de ovular. Caso houver mais de
três óvulos maduros está aconselhado a suspensão do procedimento pois o risco de
gestação múltipla é alto.
A inseminação intra-uterina, colocação dos espermatozóides preparados
dentro do útero no período ovulatório, não requer anestesia. Expõe-se o colo do
útero com o espéculo e com uma cânula delicada através do orifício do colo
injeta-se os espermatozóies capacitados dentro do útero. Após a inseminação os
espermatozóides vão em busca do óvulo e a fertilização ocorre nas trompas, in
vivo. O período após a inseminação não requer repouso ou mudança de hábitos
(exceto exposição a radiação e medicações) e na maioria das vezes a paciente não
utiliza qualquer medicação. Caso atrasar a menstruação (mais de 14 dias após a
ovulação ou a inseminação) a paciente fará um teste de gestação.
Esta técnica apresenta em torno de 16% de chance de gestação quando bem
indicada. Geralmente não se realiza este procedimento mais de 3 vezes, passando
então para a fertilização in vitro. Espermatozoides capacitados Inseminação
intra- uterina Ovulação múltipla – a fertilização ocorre in vivo, dentro da
trompa
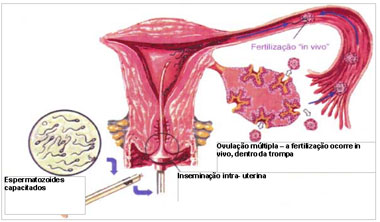
Figura: Inseminação intra-uterina
FERTILIZAÇÃO IN VITRO (FIV)
O nascimento de Louise Brown em 1978, a primeira criança concebida após
fertilização in vitro e transferência de embrião marcou o início de uma era de
extraordinário progresso no entendimento e tratamento dos problemas relacionados
à fertilidade humana. A fertilização in vitro, denominada „Bebê de Proveta“,
deve-se ao fato da fecundação do óvulo pelo espermatozóide ocorrer fora do
corpo, em laboratório, ou seja, in vitro. Originalmente a fertilização in vitro
seguida de transferência de embriões (FIV-TE) foi proposta para o tratamento dos
casos de infertilidade tubárea, ou seja, para aquelas pacientes em que as
trompas estavam ausentes ou irreparavelmente obstruídas. O aprimoramento das
técnicas de FIV ampliou as suas indicações e permitiu o seu uso para o
tratamento da infertilidade de outras causas. Atualmente se utiliza a
fertilização in vitro para tratamento de infertilidade tubária e peritoneal
(endometriose grave), fator masculino grave, infertilidade sem causa aparente e
naqueles casos em que terapêuticas mais simples não resultaram em gestação.
Sempre que a idade da mulher for maior que 35 anos se é mais liberal na
indicação desta técnica. A Injeção intracitoplasmática de espermatozóides - ICSI
é uma técnica de reprodução assistida onde a fertilização também ocorre in
vitro, entretanto não ocorre espontaneamente, ou seja, os espermatozóides são
colocados dentro do óvulo para que ocorra a fertilização. Esta técnica teve seu
primeiro relato de gestação e nascimento em 1992 e foi, sem dúvida, o maior
avanço no tratamento da infertilidade na após a fertilização in vitro
clássica.
Sempre que falamos em FIV estamos nos referindo a técnica em que o
espermatozóide entra “por suas próprias forças” para dentro do óvulo (a
fecundação ocorre in vitro e o melhor espermatozóide penetra o óvulo, sem
auxílio), quando falamos em ICSI a fertilização também ocorre fora do corpo e o
espermatozóide é colocado com auxilio de uma pipeta injetora dentro do óvulo
(auxiliamos a fecundação). FIV e ICSI são denominados procedimentos de alta
complexidade em reprodução assistida.
As etapas envolvidas em um ciclo com fertilização in vitro são as
seguintes:
|
|
indução da ovulação, |
|
|
aspiração folicular, |
|
|
fecundação in vitro e |
|
|
transferência embrionária. |
Apenas a etapa fecundação in vitro é diferente entre a FIV e a ICSI. 1.
Indução da ovulação e controle ecográfico do crescimento folicular: Induzir a
ovulação para fertilização in vitro significa utilizar medicações hormonais com
o objetivo de fazer crescer e amadurecer mais folículos do que em um ciclo
espontâneo.
Normalmente, a mulher ovula apenas um óvulo a cada ciclo, se utilizássemos
o ciclo natural teríamos em cada ciclo apenas um óvulo crescendo e teríamos, se
todas as etapas tivessem 100% de sucesso, apenas um embrião para transferência
ao útero materno. Com a indução da ovulação fazemos com que "amadureçam" mais
óvulos a cada ciclo aumentando a probabilidade de termos mais embriões.
Transferindo mais de um embrião aumentamos a chance de gestação, embora aumente
significativamente a probabilidade de gestação múltipla. O crescimento folicular
é controlado por ecografias transvaginais quase diárias a partir do oitavo dia
do ciclo. Quando pelo menos dois folículos atingem um diâmetro ecográfico de 18
a 20 mm, geralmente entre o 10º e o 14º dia do ciclo induzido, programa-se a
aspiração folicular.
O adequado controle ecográfico da ovulação, além de avaliar o crescimento
dos folículos ovarianos acompanha a proliferação endometrial. O endométrio
(tecido que reveste a cavidade uterina) é o local onde os embriões serão
transferidos. No início do ciclo menstrual ele tem espessura de até 0,5 cm e no
período ovulatório chega a 1 cm. Este tecido é preparado pelos hormônios
ovarianos para oferecer condições necessárias para que os embriões se implantem
permitindo a gestação. Caso o endométrio não apresente as condições ideais,
diminuem as chances de gestação.

Existem diversos esquemas de indução de ovulação. A medicação é escolhida
segundo as características clínicas e laboratoriais das pacientes (idade, peso,
regularidade do ciclo menstrual, valor basal do hormônio FSH, etc). A resposta
aos medicamentos é característica de cada mulher. Mulheres mais jovens,
geralmente, necessitam menos medicações para a produção do crescimento de vários
folículos. Denomina-se pacientes má-respondedoras aquelas que, apesar de usarem
medicações adequadas, não apresentam crescimento de múltiplos folículos, sendo
captados poucos ou nenhum óvulo. Mulheres com resposta ovariana adequada à
indução têm maiores chances de gestação, pois a captação de mais de 4 óvulos é
correlacionada com melhores resultados.
Citrato de Clomifene
O citrato de clomifene (CLOMID®, SEROFENE®, INDUX®) é um indutor da
ovulação de uso por via oral. Sua ação central antiestrogênica provoca aumento
dos níveis de FSH e LH secretados pela hipófise, melhorando o recrutamento
folicular. Esta medicação é mais utilizada para a indução da ovulação para
inseminação intra- uterina, quando o objetivo é a ovulação de no máximo 3
óvulos. É o indutor de ovulação mais antigo, mais barato e ativo por via oral.
Quando os folículos atingirem, à ecografia transvaginal, 20 mm aproximadamente,
eles serão considerados maduros, podendo ser utilizado o HCG (Profasi®,
Pregnil®, Ovidrel®) para a maturação final e liberação do óvulo.
Gonadotrofinas
As gonadotrofinas podem ser derivadas de urina de mulheres menopausadas
(Pergonal®, Humegon®, Metrodin®, Choragon®, Menogon®) e, mais recentemente, o
FSH (Puregon® e Gonal F®) e o LH (Luveris®) recombinantes, sintetizados por
engenharia genética. As gonadotrofinas têm custo elevado, e são de uso
subcutâneo ou intramuscular. As gonadotrofinas estimulam o crescimento de
múltiplos folículos, seu uso é iniciado no 2º ou 3º dia do ciclo. Podem ser
utilizadas doses constantes ou variáveis, em diversos esquemas de indução. O
crescimento folicular é acompanhado com ecografia transvaginal
seriada.
Quando no mínimo 2 folículos atingem a ecografia transvaginal
aproximadamente em 18 mm eles são considerados maduros, sendo então utilizado o
HCG (Profasi®, Pregnil®, Choragon®, Ovidrel®) para maturação final e liberação
do óvulo. Trinta e seis horas após a injeção do HCG, programa-se a captação de
óvulos sob controle ecográfico.
Análogos do GnRH
O uso de análogos do GnRH (uso subcutâneo ou intranasal), associado as
gonadotrofinas, trouxe duas vantagens principais para indução da ovulação no
processo FIV-TE: acentuada redução do risco de descarga prematura de LH (evita
que ocorra a ovulação antes da hora programada) e facilidade de manipulação do
ciclo pela equipe médica. Os agonistas do GnRH promovem, inicialmente, o
esvaziamento do LH e FSH da hipófise. Após, com uso continuado dos agonistas,
ocorre queda paulatina da secreção de gonadotrofinas, que permanecem em níveis
baixos e com pouca atividade biológica. Os agonistas podem ser utilizados antes
da menstruação ou no segundo dia do ciclo, dependendo do esquema utilizado pelo
médico.
O agonista é mantido durante toda a maturação folicular (fase de
crescimento dos folículos) até o momento da aplicação do HCG (medicamento
utilizado para induzir a maturação final e ruptura dos folículos).
Antagonista do GnRH
São medicações que bloqueiam a liberação de LH e de FSH pela hipófise. São
utilizados para evitar a liberação do LH hipofisário, o que acarretaria ruptura
folicular precoce e suspensão do ciclo. Também são de uso
subcutâneo.
Aspiração Folicular
É a punção por via transvaginal dos folículos ovarianos. Adapta-se uma
agulha no transdutor vaginal do ecógrafo e com ela, através da parede vaginal,
se aspira o líquido folicular, onde o óvulo está "boiando". Este procedimento é
realizado com a paciente sedada, para que não sinta dor.
Após a coleta de óvulos, a paciente permanece em repouso até se recuperar
da sedação e, geralmente, poderá em algumas horas exercer suas atividades.
Depois da aspiração folicular, a paciente pode sentir uma leve dor abdominal,
geralmente resolvida com analgésicos comuns, e desaparecendo no decorrer do dia.
Também pode haver sangramento vaginal discreto. Febre, dor aguda ou sangramento
excessivo sempre devem ser comunicados ao médico.
O líquido de cada folículo ovariano puncionado é imediatamente encaminhado
ao laboratório, onde o embriologista, através de um estereomicroscópio, localiza
os óvulos e os coloca em meio de cultura. Todo o procedimento é realizado em
ambiente extremamente limpo e com uma série de cuidados em relação à pureza do
ar. Os óvulos são manipulados rapidamente, sempre sob placas aquecidas, para que
não sofram variações importantes de temperatura. A luminosidade do laboratório
também é controlada. Os óvulos e embriões humanos são sensíveis à variações de
temperatura, pH, luminosidade, pureza do ar, etc.

Fecundação in vitro
A)Fertilização in vitro -FIV :
O sêmen é coletado por masturbação, e preparado da mesma forma que para
inseminação intra-uterina. Os óvulos ficam algum tempo em cultura (4 a 6 horas)
e, após, são inseminados in vitro, ou seja, os espermatozóides são colocados na
placa de cultura junto com os óvulos, em uma proporção aproximada de 100.000
espermatozóides para cada óvulo. As placas retornam a estufa e só serão
observadas 16 a 19 horas após para identificar se houve fertilização (penetração
do espermatozóide no óvulo).
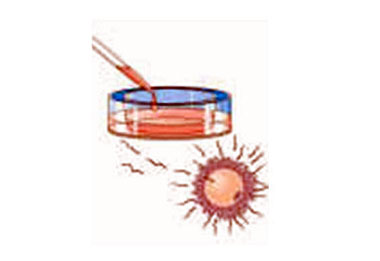

Os óvulos inseminados são observados pelo embriologista para averiguar se
houve fertilização normal ou não. Aproximadamente, de 25 a 29 horas após a
inseminação os pré-embriões serão observados para identificar os que se
dividiram precocemente. Embriões com divisão precoce têm maior potencial para a
implantação, e deverão estar entre os escolhidos para a
transferência.
B) Injeção Intracitoplasmática de Espermatozóides -
ICSI
A ICSI é uma técnica de reprodução assistida, em que a fertilização também
ocorre in vitro; entretanto, não ocorre espontaneamente, ou seja, os
espermatozóides são colocados dentro do óvulo para que ocorra a fertilização.
Esta técnica teve seu primeiro relato de gestação e nascimento em 1992 e foi,
sem dúvida, o maior avanço no tratamento da infertilidade, após a fertilização
in vitro clássica.
O sucesso da FIV depende da presença de um número mínimo de
espermatozóides com boa motilidade e morfologia. Homens com número menor do que
1 milhão de espermatozóides por ml, com motilidade limitada e menos do que 14%
de espermatozóides com forma normal têm pouca chance de fertilização na FIV
convencional. A ICSI veio solucionar os casos de infertilidade por fator
masculino grave. O dito popular "para engravidar só precisa de um
espermatozóide" só é válido quando o procedimento é a ICSI.
As indicações para ICSI, além dos casos de fator masculino, são casais com
falha e fertilização na FIV clássica (mesmo sendo os parâmetros do sêmen
normais). Esta técnica permite o uso de espermatozóides aspirados do epidídimo,
do testículo e até coletados de amostra de tecido testicular congelado nos casos
de tumores de testículo, de vasectomia, agenesia de ducto deferente,
etc.
Quando está indicada a ICSI, os procedimentos de indução da ovulação,
captação de óvulos e posterior transferência de embriões são idênticos aos da
FIV convencional. A fertilização entretanto é diferente. Os óvulos coletados são
identificados pelo embriologista através de um estereomicroscópio e, após um
período de incubação em meio de cultura especial, eles são desnudados
(retiram-se as células da granulosa que envolvem o óvulo com um líquido especial
e pipetação). Os óvulos são classificados e apenas óvulos maduros poderão ser
injetados.
O preparo do sêmen é similar ao procedimento de FIV, exceto nos casos de
azoospermia. Denomina-se:
|
|
PESA - a aspiração percutânea (através da pele) de espermatozóides do epidídimo, |
|
|
TESA - a aspiração percutânea de espematozóides do testículo e |
|
|
TESE - a extração de tecido testicular por biópsia, com posterior dissecção do tecido para identificação de espermatozóides. |
Todos estes procedimentos têm por objetivo selecionar espermatozóides
vivos para realização da injeção intracitoplasmática. As taxas de fecundação e
de gestação variam de acordo com o local de onde são retirados os
espermatozóides.
A decisão de recuperar os espermatozóides do testículo ou do epidídimo
depende da causa da azoospermia. Em casos de obstrução epididimária ou agenesia
de ducto deferente, utiliza-se a punção de epidídimo. Nos casos de fatores
testiculares, a alternativa é a punção biópsia testicular; nesses casos, os
espermatozóides podem demorar para adquirir motilidade.
No procedimento de ICSI propriamente dito, o espermatozóide selecionado é
imobilizado pela pressão da pipeta injetora sobre a sua cauda, sendo então
aspirado (pela cauda) para dentro da pipeta injetora. A pipeta de sucção fixa o
óvulo e a pipeta injetora, já carregada com o espermatozóide, penetra no óvulo.
Realiza-se uma discreta aspiração para confirmar que a membrana do óvulo foi
mesmo rompida e, então, o espermatozóide é colocado no citoplasma do
óvulo.

A transferência dos pré-embriões obtidos mediante ICSI ocorre da mesma
forma que na fertilização in vitro convencional.
4.Transferência de embriões:
A transferência é um procedimento relativamente simples, que não necessita
sedação. A mulher deve estar com a bexiga cheia, isto retifica o útero (das
mulheres com útero de curvatura anterior) e facilita o controle ecográfico da
transferência dos embriões. A paciente fica em posição ginecológica, coloca-se o
espéculo, e lava-se a vagina com soro fisiológico ou meio de cultura. Os
pré-embriões selecionados para transferência são aspirados em um cateter muito
fino, com mínima quantidade de líquido. A seguir, o cateter "carregado" é
passado através do orifício cervical externo e interno, e os pré-embriões
transferidos para o endométrio, conforme figura abaixo.

Os pré-embriões, geralmente, são transferidos para o útero materno no
período de 48 a 72 horas após a punção. Eles estarão com 4 a 8 células. Nesta
etapa, a regularidade dos blastômeros (cada célula do pré-embrião é denominada
blastômero), e a presença de fragmentação são os critérios mais utilizados para
selecionar os embriões que serão transferidos. Em casos especiais, pode-se optar
pela transferência no 5º dia, em estágio de blastocisto.
A legislação brasileira permite que se transfiram, no máximo, quatro
embriões. Atualmente, transfere-se cada vez menos embriões, principalmente em
mulheres jovens e com embriões com alto potencial de implantação, para diminuir
as gestações múltiplas. Depois da transferência, a paciente pode ficar alguns
minutos em repouso. Recomenda- se que faça repouso relativo por 2 dias após a
transferência (pelo que se estudou até agora, o repouso não tem qualquer
significado sobre as taxas de gestação).
A dosagem do -HCG (hormônio produzido pelo embrião) é realizada no 14º dia
após a punção de óvulo, ou no 12º, após a transferência dos embriões, para que
assim se faça o diagnóstico da gestação. Sete a dez dias após o resultado do
teste de gestação positivo, realiza-se uma ecografia transvaginal para
identificação de saco gestacional intra-uterino e embrião. Após comprovação da
gestação viável (embrião com batimentos cardíacos) as taxas de abortamento são
similares aquelas de gestações obtidas sem procedimentos de reprodução
assistida.
Taxa de sucesso após fertilização in vitro e
ICSI
As chances de gestação dos procedimentos de reprodução assistida estão em
parte determinados

pelos equipamentos e profissionais do centro. Entretanto, os fatores independentes que mais afetam as taxas de sucesso são o número de embriões que se transfere ao útero (tabela) e a idade da mulher (tabela). Aproximadamente, 15% das pacientes têm abortamento, o que não parece estar aumentado em relação as gestações espontâneas.
Nas tabelas abaixo, estão os dados do registro latino americano de
reprodução assistida, mostrando a taxa de nascidos vivos por ciclo de aspiração
folicular e por transferência embrionária, segundo o número de embriões
transferidos e a idade da mulher nos procedimentos de reprodução assistida de
alta complexidade.

Tabela: Taxa de gestação clínica de acordo com o número de embriões
transferidos em procedimentos de fertilização in vitro (modificada da Red
Latinoamericana de Reprodução Assistida 2003). 
Tabela: Taxa de gestação clínica de acordo com a idade da mulher em
procedimentos de Fertilização in vitro (modificada da Red Latinoamericana de
Reprodução Assistida 2003).
Razões para suspensão de ciclo de reprodução
assistida:
Os ciclos de reprodução assistida podem ser suspensos; isto significa que,
por algum motivo, não serão realizadas todas as etapas: indução da ovulação,
aspiração folicular, fecundação in vitro e transferência embrionária. Entre os
motivos para suspensão do ciclo estão a falha de resposta à indução da ovulação
(não desenvolvimento de folículos), aparecimento de cistos ovarianos, ruptura
prematura dos folículos, cônjuge não conseguir coletar o sêmen, não haver
fecundação in vitro, etc.
Complicações mais freqüentes nos procedimentos de
reprodução assistida: Maternas
Hiperestimulação ovariana:
É uma resposta exagerada do ovário à estimulação da ovulação, em que o
número de folículos em crescimento é maior que o desejado. Caracteriza-se pelo
aumento do tamanho dos ovários e distensão abdominal devido à retenção de
líquidos. Nos casos mais graves, sintomas como náusea, vômitos, dificuldade
respiratória, acúmulo de liquido dentro do abdômen, ausência de diurese pode
ocorrer, e a paciente deve ser hospitalizada. Felizmente, apenas 1% dos casos
necessitam internação. Esta probabilidade encontra-se aumentada em mulheres
jovens com síndrome dos ovários policísticos.
Gravidez Tubária:
É a implantação do embrião fora da cavidade uterina, mais comumente na
trompa. Este diagnóstico pode ser feito ao redor de 21 dias após a transferência
embrionária quando, por ecografia, pode-se visualizar o saco gestacional (sinal
inicial de gestação). Esta complicação ocorre em torno de 1 a 2% das gestações
espontâneas; em ciclos de FIV, a incidência aumenta para 4%, provavelmente
devido à ocorrência de patologias tubárias e uterinas
pré-existentes.
Torção ovariana:
O ovário hiperestimulado pode duplicar ou triplicar de tamanho. O peso
aumenta, e a distensão abdominal (aumento do volume do abdômen) pode facilitar
sua torção, estrangulando o sistema vascular, e originando dores tipo cólica. Se
o quadro não se resolve espontaneamente, poderá ocorrer necrose (morte celular)
e, conseqüentemente, hemorragia ovariana (sangramento dentro do abdômen). Esta é
uma emergência médica que requer solução imediata. Felizmente, ocorre em menos
de 1% dos casos.
Outras complicações:
Poderão ocorrer complicações no local da punção transvaginal durante a
aspiração folicular, ainda que de baixa freqüência, sangramento por lesão da
parede vaginal, infecção pélvica , abscesso tubário e, finalmente, lesões de
estruturas vizinhas tais como intestino,bexiga, uretra e grandes
vasos.
Defeitos de nascimento:
A porcentagem de malformações dos recém-nascidos, produtos das técnicas de
fertilização in vitro, não é maior que a da população em geral, tanto mundiais
ou americanas (2 a 2,4 % dos examinados).
Em casos de fator masculino grave, realizada a ICSI, em que não ocorre a
"seleção natural" para penetração do espermatozóide, devemos considerar que
podemos estar transferindo problemas genéticos a descendência. Quando existe
azoospermia, quase 12% dos espermatozóides têm alterações genéticas; quando a
espermatogênese é normal, a porcentagem é menor do que 0,5%.
Gravidez múltipla:
A proporção de multigestação é conseqüência direta do número de embriões
transferidos (tabela) e da idade da mulher. A taxa global de multigestação é de
29% . Isso significa que de 100 gestações, 29 apresentam dois ou mais sacos
gestacionais e destes, 10% serão reduzidos, espontaneamente, para somente um
saco gestacional, evento que ocorre, habitualmente, antes da 12º semana de
gestação.

Tabela: Taxa de gestação múltipla, de acordo com a idade da mulher em
procedimentos de Reprodução Assistida (modificada da Red Latinoamericana de
Reprodução Assistida 2003). · 2 Sacos gestacionais (gêmeos) * 3 ou mais sacos
gestacionais (trigêmios ou mais)
Dependendo do acesso a centros hospitalares adequados e das condições
físicas da paciente, o desenrolar da gestação gemelar para a mãe e o bebê não
deve trazer grandes diferenças em relação às gestações únicas. As gestações
triplas e quádruplas associam-se à maiores taxas de abortos, mortes fetais,
partos prematuros e maior morbimortalidade neonatal. Segundo dados da Rede
Latinoamericana de Reprodução Assistida, a taxa de prematuridade extrema
(nascimento com menos de 31 semanas) é de 3,4% para gestações únicas, 18,5% para
gemelares, 34% para trigêmeos e 42,5 % para quadrigêmeos.
A prematuridade e as complicações neonatais determinam, em muitos casos,
seqüelas permanentes e graves para os nascidos de gestações triplas ou mais. A
única maneira de diminuir a taxa de multigestação é diminuindo o número de
embriões a transferir, ocasionando impacto nas taxas de gestações. Este assunto
deve ser discutido entre a equipe de profissionais e o casal.
O objetivo dos tratamentos em reprodução assistida é sempre a gestação
única. Atualmente, com a melhoria dos laboratórios de fertilização in vitro
existe uma tendência à transferência de 2 a 3 embriões. Existem alguns grupos
que preconizam a transferência de apenas um embrião - muito bem selecionado
havendo, então, taxas muito baixas de gemelaridade.
Embriões Excedentes: O que fazer?
No início de um tratamento de Fertilização in vitro, uma questão bastante
importante para ser discutida com os casais diz respeito ao número de óvulos
que, potencialmente, serão produzidos durante o ciclo. Este número está
diretamente relacionado ao número de embriões que serão obtidos. Um número maior
de embriões produzidos permite a escolha daqueles que, potencialmente, têm
melhores condições para implantação, aumentando as chances de sucesso.
Entretanto freqüentemente sobram embriões de boa qualidade, que podem ser
congelados e transferidos em outro ciclo. O congelamento de embriões nada mais é
do que a tentativa de aumentar as chances de gestação de um único ciclo de
estimulação ovariana.
Antes da criopreservação de embriões, a mulher que produzia muitos óvulos
tinha apenas alguns óvulos fertilizados ou corria, o risco de ter vários embriões
descartados (não transferidos), porque, no máximo, 3 ou 4 embriões podiam ser
transferidos para o útero com segurança. Atualmente, existem protocolos de
congelamento de embriões com chance real de gestação após descongelamento.
Provavelmente, em breve possamos obter com embriões congelados taxas de gestação
similares àquelas de embriões frescos. Segundo o Conselho Federal de Medicina,
atualmente os embriões excedentes aos ciclos de Fertilização in vitro podem ter
três destinos: congelamento, doação a outro casal ou doação para pesquisa com
células tronco. A maioria dos casais opta pelo congelamento. Quanto ao tempo que
embriões podem ficar congelados é muito discutido. Já existem relatos de
gestações com nascimento de bebês saudáveis com mais de 10 anos de
congelamento.


Nenhum comentário:
Postar um comentário